 Por Fernando Gomollón-Bel (CSIC)*
Por Fernando Gomollón-Bel (CSIC)*
Ahora que muchos estaréis de vacaciones quizás hayáis notado que, en vuestro destino, el jabón hace menos espuma cuando os ducháis. O igual os pasa justo lo contrario. Os habéis llevado vuestro champú de siempre, pero no es lo mismo. ¿Qué está pasando?
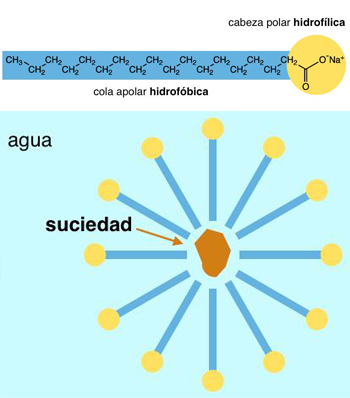
Arriba: esquema de una molécula de jabón con sus dos partes, la cabeza hidrófila (amarillo) y la cola hidrófoba (azul). Abajo: esquema de una micela con grasa atrapada en su interior.
La respuesta, como sucede casi siempre, está en la Química. Antes de nada, hemos de recordar por qué el jabón limpia. El jabón está formado por moléculas que tienen una cola que repele el agua (hidrófoba) y una cabeza que es soluble en ella (hidrófila). Esta propiedad hace que el jabón, al entrar en contacto con el agua, forme lo que los científicos llaman micelas: esferas en las que todas las cabezas están en contacto con el agua y todas las colas orientadas hacia el interior. A esta cavidad interna le encantan las grasas y es por eso que las micelas de jabón atrapan las manchas y la suciedad a la perfección.
Probablemente ahora os estéis preguntando: ¿todo esto qué tiene que ver con las vacaciones? Resulta que el hecho de que un jabón haga más o menos espuma, o limpie más o menos según el agua que utilicemos, es debido a las micelas y a la dureza del agua. La dureza es una medida de la cantidad de cal que tiene disuelta el agua. Así, por ejemplo, el agua de Zaragoza es muy dura (tiene mucha cal) mientras que la de La Coruña es muy blanda (apenas tiene).
¿En qué afecta esto a los jabones? Las cabezas hidrófilas de las moléculas de jabón se llevan también muy bien con los iones de calcio y magnesio con carga positiva que contiene la cal.
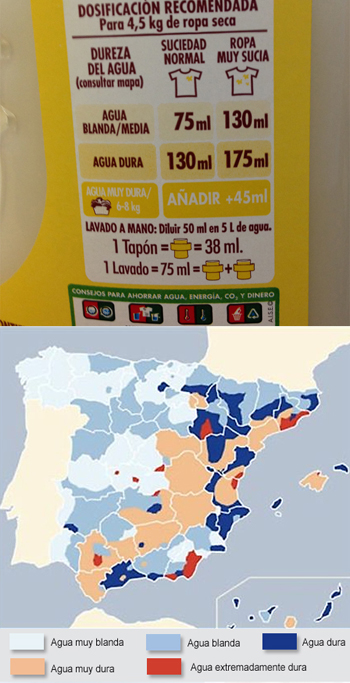
Arriba: dosis de jabón recomendada por el fabricante. Abajo: mapa de la dureza del agua (TecDepeur.com).
Así, cuando hay mucha cal (cuando el agua es muy dura), las moléculas de jabón empiezan a asociarse con estos iones y las micelas se rompen o no llegan a formarse. Por lo tanto, en zonas con aguas muy duras, los jabones formarán menos espuma y lavarán menos.
Técnicamente no es que laven menos, sino que necesitaremos más cantidad de jabón, ya que muchas de sus moléculas estarán asociándose con el calcio y el magnesio, y no serán capaces de formar micelas y atrapar la suciedad.
De hecho, si miráis en la parte de atrás de vuestro detergente, deberíais encontrar algo similar a lo que refleja la imagen de arriba a la derecha.
Como veis, el envase incluye una tabla en la que se indica la cantidad de jabón recomendada según el tipo de agua de la zona. Generalmente, la etiqueta también incluye un pequeño mapa de España que debería parecerse al que véis a la derecha.
Una solución que nos permitiría gastar menos jabón y contaminar un poco menos el planeta sería hacernos con un descalcificador. Estos aparatos tratan el agua mediante una serie de procedimientos físicos (filtraciones con carbón activo, ósmosis) y químicos (con sustancias que, como las moléculas de jabón, atrapan los iones calcio y magnesio) que eliminan la mayor parte de la cal del agua. Pero esto ya es otra historia que quizás os contemos otro día.
* Fernando Gomollón Bel es investigador en el Instituto de Síntesis Química y Catálisis Homogénea (UZ-CSIC) y colabora habitualmente en el blog Moléculas a reacción. Esta entrada participa en el XXXVII Carnaval de la Química – Edición Rb – alojado en este último blog.




